Autores:
o ALUMNADO:Clara Aranda Fernández (CES Lope de Vega, Córdoba)
Luisa Castro Jiménez (CES Lope de Vega, Córdoba)
Elena Coba Lama (CES Lope de Vega, Córdoba)
José Manuel Luque López (CES Lope de Vega, Córdoba)
Carmen Marina de la Torre Márquez (CES Lope de Vega, Córdoba)
Celia Badillo Márquez (IES Martín Rivero, Ronda-Málaga)
Ruby Liora Kien (IES Martín Rivero, Ronda-Málaga)
Erika Nayeli Villalta Solano (IES Martín Rivero, Ronda-Málaga)
o PROFESOR:
Marcos Mateo Fernández (CES Lope de Vega, Córdoba)
o INVESTIGADORES:
Tania Merinas Amo (Universidad de Córdoba)
Marcos Mateo Fernández (Universidad de Córdoba)
Carmen Bellido Pedraza (Universidad de Córdoba)
Zahira Fernández-Bedmar (Universidad de Córdoba)
Ángeles Alonso Moraga (Universidad de Córdoba)
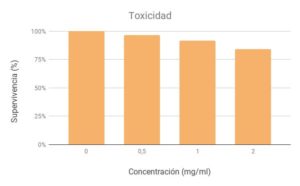
TOXICIDAD
Primero debemos realizar una puesta de huevos, donde se prepara en un frasco de cristal el medio donde las moscas pondrán sus huevos durante 12-24h. Este medio se realiza con una porción de levadura y agua destilada hasta que quede en un estado semisólido (importante evitar que las moscas se queden pegadas, por ello no debe quedar líquido ni demasiado húmedo). Pasado este tiempo, se hicieron 2 diluciones 1:1 con el tipo de chocolate que queremos evaluar partiendo de la concentración mayor 2 mg/ml. Las moscas control fueron tratadas con agua destilada.
Después de preparar las diluciones, seguimos con el reparto de larvas para cada una de estas. Se toma un recipiente en el que se encuentran las larvas con su comida (puesta de huevos). El objetivo de esto es separar larvas de las moscas ya adultas que están muertas. Para ello se coge un recipiente vacío y se le pone una malla para poder realizar el proceso. Cuando ya se han separado las moscas adultas de las larvas, se añaden 100 larvas en los tubos de ensayos preparados con cada dilución de nuestro compuesto de interés. Hay que evitar que las larvas queden adheridas a las paredes de los recipientes de las diluciones, si ocurre habrá que golpear suavemente hasta que se depositen en el fondo. Ya con las larvas introducidas en los tubos, a cada uno se le añade un papel con la función de prevenir la humedad de dentro. Y finalmente, para cubrir el tubo se le pone algodón, así para que las larvas no escapen, pero puedan respirar.
El ensayo finaliza con la recogida de las moscas adultas emergidas después de 12 días, para que las larvas se desarrollen. El experimento se realiza por triplicado. Finalmente, se realiza el test estadístico Chi-cuadrado para comparar con el control.
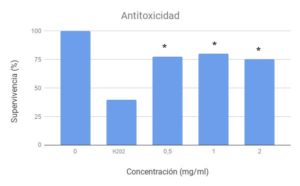
ANTITOXICIDAD
Consiste en comprobar la capacidad que tiene nuestro compuesto de interés en revertir el daño oxidativo provocado por un agente oxidante como es el peróxido de hidrógeno. En este ensayo se realiza de manera similar al ensayo de toxicidad con algunas diferencias. Añadimos un control positivo formado por agua destilada y peróxido de hidrógeno para evaluar la viabilidad de las larvas tratadas con peróxido de hidrógeno. Cada concentración de chocolate llevará añadida 50 microlitros de peróxido de hidrógeno. De esta manera podemos comprobar el potencial antioxidante de nuestro compuesto al revertir el daño provocado por la genotoxina, o si por el contrario, ejerce un efecto sinérgico y se aumentaría el daño. Este sería el ensayo para evaluar el potencial antioxidante de nuestra sustancia.
TRATAMIENTO ESTADÍSTICO
Para el ensayo de toxicidad y antitoxicidad hemos realizado una prueba estadística chi-cuadrado para comparar proporciones. Si el valor estadístico experimental es superior al valor estadístico teórico (5.02) es superior concluimos que hay diferencias significativas entre el control y la concentración testada. Si es inferior a ese valor teórico, concluimos que las diferencias que hay entre ambas proporciones no son significativas y se deben al azar. En el caso del ensayo de antitoxicidad, comparamos el control positivo con las demás concentraciones. En cada concentración las que cabría esperar son las del control positivo con peróxido de hidrógeno. Se procede de igual manera que en el ensayo de toxicidad.
¿Qué se pretende demostrar?
El cáncer es originado por factores internos y externos y ofrece una gran variedad de dianas para su inhibición en estadíos tempranos de las enfermedades como por ejemplo sustancias antioxidantes. Estas sustancias antioxidantes se pueden encontrar en la dieta y confieren protección frente a las enfermedades originadas por el estrés oxidativo. Se ha demostrado que algunos constituyentes del chocolate poseen propiedades antioxidativas. Debido a esta razón y a que el chocolate es un alimento muy consumido en todo el mundo, el propósito de esta investigación fue determinar el potencial saludable y antioxidante del chocolate llevando a cabo ensayos de toxicidad y antitoxicidad en Drosophila melanogaster.
Dirigido a:
- Secundaria
- Universidad
Materiales necesarios:
- Organismo modelo Drosophila melanogaster
- Tubos de ensayo
- Medio cultivo para Drosophila.
- Levadura
- Agua destilada
- Peróxido de hidrógeno
- Chocolate en polvo
- Frascos de cristal
- Pipetas y material para realizar disoluciones y diluciones.
Riesgos:
- Tomar precaución con el peróxido de hidrógeno usando guantes.
Enlaces:
- Mateo-Fernández, M., Merinas-Amo, T., Moreno-Millán, M., Alonso-Moraga, Á. and Demyda-Peyrás, S. 2016. In vivo and in vitro genotoxic and epigenetic effects of two types of cola beverages and caffeine: a multi-assay approach. BioMed Res Int 2016, 15.
- Merinas-Amo, T., Tasset-Cuevas, I., Díaz-Carretero, A.M., Alonso-Moraga, Á. and Calahorro, F. 2016. In vivo and in vitro studies of the role of lyophilised blond Lager beer and some bioactive components in the modulation of degenerative processes. Journal of Functional Foods 27, 274-294.
- Anter, J., I. Tasset, S. Demyda-Peyrás, I. Ranchal, M. Moreno-Millán et al., 2014. Evaluation of potential antigenotoxic, cytotoxic and proapoptotic effects of the olive oil by-product “alperujo”, hydroxytyrosol, tyrosol and verbascoside. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 772: 25-33.
Para saber más:
Reiter, L. T, Potocki, L., Chien, S., Gribskov, M., and Bier, E., 2001. “A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster,” Genome Research, vol. 11, no. 6, pp. 1114–1125.
Suzuki, D., and A. Jif, 1992, «Genética». Ed. Interamericana. McGraw-Hill.
Observaciones:
- Se puede realizar el experimento con cualquier sustancia que se quiera probar.