Autores:
José Antonio Martínez Pons |  |
| Fig. 1.-Efectos de la corrosión en una locomotora “Mastodonte” | |
La corrosión es un proceso electroquímico en el que se destruye la red cristalina de un metal al reaccionar con el electrolito que lo rodea, En una visita a un museo ferroviario es fácil observar como la chapa de algunos vehículos está corroída hasta el punto de estar perforada. la corrosión se produce preferentemente en los lugares en que cuando el vehículo estaba en servicio se aplicó una placa de bronce. ( Fig. 1).
La corrosión es una consecuencia de los fenómenos red-ox que se producen cuando dos metales diferentes entran en contacto a través de un electrolito. formándose una pila voltaica. El elemento de menor potencial de reducción (en rigor, potencial de electrodo) se oxida y el otro se reduce. Son los electrodos en el cátodo se produce reducción en el ánodo la oxidación
La teoría completa de la corrosión es bastante más compleja pero para lo que aquí interesa esta explicación parece suficiente.
Se visualiza el fenómeno construyendo una “Pila de monedas”
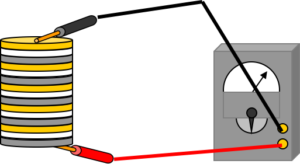 |
| Figura 2. Esquema de la pila con monedas. Es semejante al dispositivo construido por Volta ”apilando” discos de Cu y Zn |
Se toman varios pares de monedas de dos materiales diferentes, como las antiguas pesetas de cobre y aluminio. Se recortan cuadraditos de papel de filtro y se humedecen con una disolución salina, apilándose como como se muestra en la Fig. 2. Con el polímetro se registra la medida de la tensión. Previamente se puede haber ensayado con el papel seco.
También puede encenderse un LED ROJO, teniendo en cuenta que el LED es un DIODO y solo funciona en una dirección, se apoyan las patitas de una forma y si no funcionan se cambian. También es posible que no funcione debido a que la tensión suministrada no es suficiente, en cuyo caso habría que “apilar” más pares de monedas.
| |
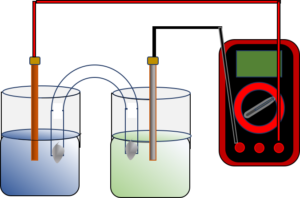
| Figura 3. Esquema de la pila Daniell. El puente salino tiene por objeto cerrar el circuito. Para medir la tensión deberá seleccionarse la escala de voltios en CC y empezar con un fondo de escala alto, reduciéndose progresivamente. Si el aparato marca “-“ inviértanse los contactos |
Pila Daniell. Se trata de un experimento que permite una cierta cuantitatividad.
 |
| Figura 4 Versión simplificada de la pila Daniell, con dos vasos de polietileno y un papel de filtro impregnado en disolución salina como puente salino |
Se verterá unos 150 cm3de las disoluciones de sulfato de cinc y cobre en cada uno de los vasos. Se llenará el tubo en U con la disolución de nitrato de potasio y se taparán ambas bocas con una bolita de algodón. Se dispondrá las disoluciones se introducirán los electrodos, se invertirá con cuidado el tubo en “U” y se situará procurando que las bocas se introduzcan los electrolitos correspondientes
En las pilas Daniell y Volta el Zn es el ánodo y se oxida, el Cu es el cátodo y se reduce. Ánodo es de dónde salen los electrones de la pila, ánodo = camino hacia arriba, cátodo = camino hacia abajo por dónde entran los electrones en la pila.
Visualización de la corrosión.
Aunque la corrosión suele ser un proceso relativamente lento se puede visualizar acelerándolo un poco., Para ello se precisa una lámina de hierro o acero, una pieza de otro metal, como cobre y un poco de papel de filtro humedecido en disolución de ácido sulfúrico al 10 %. Colocar el cobre sobre el hierro poniendo en medio el papel humedecido.
 |  |
| Figura 5: Algunos de los materiales utilizados | Figura 6 Montajes de la pila de volta y de la visulización de la corrosión |
|
| |
| Figura 7. Pila Daniell improvisada y resultados de la corrosión sobre la espátula de acero | |
¿Qué se pretende demostrar?
- La corrosión en la forma más habitual de deterioro químico de los metales estructurales , especialmente los materiales férricos
Dirigido a:
- Gran Público
- Primaria
- Secundaria
- Con una mayor y rigurosa profundización puede dirigirse a estudiantes universitarios.
Materiales necesarios:
- Chapas de hierro acero, zinc, cobre o bronce y eventualmente aluminio.
- Disolución de electrolito, puede ser por ejemplo ácido sulfúrico diluido al 10%
- Vasitos de plástico.
- Papel de filtro
- Multímetro.
- Disoluciones de sulfatos de cobre y cinc y de nitrato sódico aprox. 1 M
- Tubo en “U” Puede improvisarse doblando un pedazo de goma de plástico o silicona de unos 20 mm de diámetro.
- Pueden ser de utilidad pinzas de plástico para sujetar los elementos ( Ver foto)
Riesgos:
- Ninguno, aunque conviene que las disoluciones las prepare el profesor y que las manipulaciones se hagan con guantes.
Enlaces:
Diaz Peña, M. Roig Muntaner A. Química Física Vol. II Alhambra Madrid .1976.
Cataldo F. Arriaga, S. Hernández, D. (2019) Pilas Una Forma Experimental De Enseñanza De Los Procesos Re-dox. Educación Química. Vol. 30(3) 24-23
Para saber más:
Pourbaix, M. Lecciones de corrosión. CEBELCOR. Bruselas 1987. .
Observaciones:
Los experimentos que se proponen se han pensado para mostrarse a nivel cualitativo pero muy fácilmente pueden ampliarse a cuantitativo, Para ello se requiere trabajar con más precisión y manejar la tabla de potenciales de electrodo y la ecuación de Nernts.
Agradecimiento: A la Profesora Manuela Martín Sánchez por su paciente lectura del borrador de esta ficha y sus atinadas sugerencias.